Científicos de Rusia, proponen modelo de la actividad de los péptidos en la membrana hacia su uso en la terapia antimicrobiana
Moscú, Rusia, Eurasia.- Investigadores del Laboratorio de Bioelectroquímica del Instituto A.N. Frumkin de Química Física y Electroquímica de la Academia de Ciencias de Rusia han propuesto un modelo físico unificado que describe todos los cambios en la estructura de la membrana causados por péptidos antimicrobianos en un amplio rango de concentraciones: altas, bajas e incluso variables (primero bajas, luego altas).
Los resultados de los cálculos teóricos y los estudios experimentales se publicaron en dos artículos complementarios en la revista Langmuir.
Los péptidos antimicrobianos son compuestos naturales capaces de dañar las membranas celulares de los microorganismos. Constituyen la primera línea de defensa innata, diseñada para prevenir la infección por bacterias patógenas. Los péptidos antimicrobianos forman parte del sistema inmunitario tanto de humanos como de animales y pueden ser producidos, entre otros, por la piel y las membranas mucosas. Se han encontrado numerosos péptidos antimicrobianos en el veneno de abeja, la hemolinfa de insectos y la piel de anfibios.
En los últimos 50 años, se han descubierto y sintetizado más de 3000 péptidos antimicrobianos. Estos son de gran interés para la comunidad científica, ya que representan una base potencial para fármacos de última generación: fármacos con un amplio espectro de actividad contra virus, bacterias y hongos, a los que los patógenos tendrán dificultad para desarrollar resistencia.
Los péptidos antimicrobianos podrían solucionar el problema de la creciente tasa de mortalidad por infecciones nosocomiales. Cada vez es más frecuente que las personas sean hospitalizadas para una cirugía rutinaria y desarrollen una enfermedad grave causada por microorganismos resistentes, es decir, que han sobrevivido al tratamiento con desinfectantes y han desarrollado resistencia a los antibióticos existentes.
A diferencia de los antibióticos conocidos, que afectan procesos fisiológicos en las células bacterianas, como la síntesis de la pared celular o la duplicación del ADN, los péptidos antimicrobianos atacan principalmente la membrana celular. Las membranas celulares se basan en una bicapa (compuesta por dos monocapas) de moléculas lipídicas. Esta bicapa forma una barrera impermeable que protege a las células vivas, incluidas las bacterias, del entorno externo. La formación de defectos en la membrana lipídica, permeables a iones y moléculas polares, es perjudicial para la célula y conduce a su muerte. Los péptidos antimicrobianos, en su mayoría, son capaces de crear dichos defectos conductores (poros) en las membranas celulares.

Desarrollar un modelo que vincule la estructura del péptido con sus propiedades es necesario para encontrar un equilibrio entre su citotoxicidad y actividad antimicrobiana, y para impulsar el desarrollo de fármacos basados en péptidos antimicrobianos, una tarea crucial. Desafortunadamente, aún no se han realizado ensayos clínicos a gran escala con péptidos antimicrobianos. Los científicos todavía están lejos de comprender la relación entre la estructura del péptido y su capacidad para combatir los microbios.
Casi el 90 % de los péptidos antimicrobianos conocidos son moléculas pequeñas, compuestas por menos de 100 aminoácidos. En su mayoría tienen carga positiva, por lo que la superficie cargada negativamente de las células bacterianas los atrae con mayor fuerza que la superficie casi neutra de las células eucariotas del cuerpo humano. Su estructura contiene fragmentos tanto hidrofóbicos (repelentes al agua) como hidrofílicos (reactivos al agua). Entre los ejemplos de péptidos antimicrobianos que se estudian actualmente se encuentran la melitina y la magainina. La primera se aísla del veneno de abeja, mientras que la segunda está presente en el moco cutáneo de las ranas sudamericanas.
Investigadores del Laboratorio de Bioelectroquímica del Instituto de Química Física y Electroquímica de la Academia de Ciencias de Rusia han propuesto un modelo físico unificado que describe todos los cambios en la estructura de la membrana causados por péptidos antimicrobianos en un amplio rango de concentraciones: altas, bajas e incluso variables (primero bajas, luego altas). Los modelos teóricos se confirmaron mediante complejos experimentos que examinaron la interacción de los péptidos antimicrobianos melitina y magainina con membranas lipídicas modelo. Los resultados de los cálculos teóricos y los estudios experimentales se publicaron en dos artículos de la revista Langmuir.
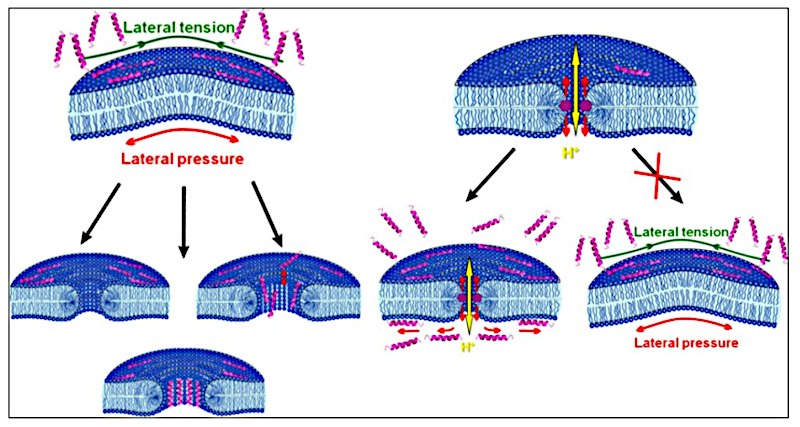
«La premisa fundamental de nuestro modelo es que los péptidos antimicrobianos, debido a la presencia simultánea de fragmentos hidrofóbicos e hidrofílicos, pueden insertarse parcialmente en la monocapa lipídica de la membrana celular. Esto aumenta la superficie de la monocapa bacteriana, generando una presión lateral (presión bidimensional en el plano de la monocapa lipídica) que se extiende desde el péptido insertado. Como resultado, se crea tensión en la monocapa opuesta de la membrana cerrada, diseñada para compensar el desequilibrio de área entre las dos monocapas de la bicapa lipídica, y se forman poros en la membrana», explicó Ser, investigador principal del laboratorio de bioelectroquímica del Instituto de Química Física y Electroquímica de la Academia de Ciencias de Rusia y doctor en ciencias físicas y matemáticas. Gay Akimov.
Los autores del estudio examinaron dos posibles escenarios para la formación de poros. Según el escenario local, los poros se originan en la vecindad inmediata de los péptidos. Su inserción en la membrana a altas concentraciones provoca la formación de estructuras similares a canales de péptido-lípido. En el escenario no local, la ubicación de los poros no está relacionada con la posición de los péptidos. Según este escenario, los péptidos se adsorben a la membrana, comprimiendo una capa y estirando la otra, lo que genera un desequilibrio en la presión y la tensión lateral entre las capas. Con la formación de poros, este desequilibrio disminuye, un descubrimiento importante de este estudio.
«Anteriormente se suponía que los poros se originaban donde los péptidos se insertaban en la membrana. Hemos demostrado que esto no es así. Los poros lipídicos se originan porque los péptidos incrustados en la monocapa alteran la superficie de la membrana y crean un desequilibrio de presión y tensión». «La membrana se rompe porque los péptidos se han incrustado en ella, aunque no necesariamente en el mismo lugar», explicó Oleg Batishchev, doctor en Ciencias Físicas y Matemáticas y director del Laboratorio de Bioelectroquímica.
Las hipótesis propuestas se pusieron a prueba experimentalmente. Mediante la técnica de fijación de potencial local, científicos del Instituto de Química Física y Electroquímica de la Academia de Ciencias de Rusia midieron las corrientes iónicas y registraron la aparición de señales de conductividad. Estas señales corresponden a la formación de canales (poros) por donde pasan los iones. Se estudió de forma independiente la capacidad de un colorante disuelto, la calceína, para penetrar la membrana, lo cual también se debe a la formación de poros bajo la influencia de los péptidos antimicrobianos.
En la literatura se han descrito tres tipos de señales eléctricas asociadas a la formación de poros en la membrana. «Estudiamos la interacción de los péptidos con la membrana mediante métodos indirectos. Registramos la conductividad y, a partir de ella, determinamos el tamaño de los poros. Creemos que los picos de conductividad estrechos observados corresponden a poros lipídicos, mientras que los picos multinivel corresponden a poros péptido-lípido, en los que la molécula de péptido se equilibra en el borde del poro en diversas orientaciones», explicó Oleg Batishchev.
De este modo, investigadores del Instituto de Química Física y Electroquímica de la Academia de Ciencias de Rusia han demostrado experimental y teóricamente que los péptidos antimicrobianos deforman la membrana y promueven la formación de poros. El proceso depende fundamentalmente de la concentración del péptido. A concentraciones superiores a un umbral, el desequilibrio de tensión y presión entre las monocapas es suficiente para romper la membrana. Se forman poros a través de los cuales pueden pasar moléculas grandes. A bajas concentraciones de péptido, se forman poros pequeños permeables solo a protones e impermeables a iones o moléculas de tinte disueltas. Curiosamente, los péptidos antimicrobianos adsorbidos en la membrana a bajas concentraciones impiden la formación de más poros. El Departamento de Química y Electroquímica de la Academia de Ciencias de Rusia trató primero la membrana con una pequeña cantidad de péptidos (a una concentración entre 20 y 40 veces inferior al umbral) y luego aumentó la concentración por encima de dicho umbral.
El resultado fue sorprendente: la membrana presentaba una permeabilidad muy baja al colorante y no se observaron picos eléctricos correspondientes a la formación de poros lipídicos. Por lo tanto, la adición de péptidos antimicrobianos en bajas concentraciones no daña la membrana, sino que la protege de los efectos de las altas concentraciones de péptidos. A bajas concentraciones de péptidos, se forman poros lipídicos permeables a los protones, lo que restablece el equilibrio entre las monocapas. Como resultado, al aumentar la concentración de péptidos, el desequilibrio se produce en menor grado, pero no es suficiente para romper la membrana”, explicó Oleg Batishchev.
La capacidad de los péptidos para unirse a la membrana depende de la presencia de aminoácidos hidrofílicos e hidrofóbicos, lo cual está determinado por la estructura química del péptido. Por lo tanto, la estructura del péptido determina la eficacia del tratamiento con una pequeña cantidad de péptidos para prevenir la formación de poros con aumentos posteriores en la concentración. Los experimentos han demostrado que las bajas concentraciones de melitina (a diferencia de la magainina) no suprimen por completo la formación de poros.
“Estos resultados nos permiten avanzar hacia el uso terapéutico de péptidos antimicrobianos. En primer lugar, es necesario aprender a estabilizar estructuras de tipo canal de larga duración mediante interacciones específicas entre péptidos. En segundo lugar, se ha demostrado que las bajas concentraciones de péptidos protegen la membrana, lo que permite que las bacterias desarrollen resistencia. Esto determina la dosis del futuro fármaco. En tercer lugar, el pretratamiento con bajas concentraciones de péptidos puede proteger las células sanas, garantizando así que la terapia con concentraciones más altas sea segura para ellas —concluyó Oleg Batishchev—.



